Di dalam termodinamika dikenal ada 5 proses yaitu :
- Proses pada tekanan konstan (isobarik)
- Proses pada volume konstan (isokhorik)
- Proses pada temperatur konstan (isotermal)
- Proses adiabatis reversibel (isentropi)
- Proses polytropis.
Persamaan gas ideal :

Perubahan energi dalam :

Perubahan entalpi :

Indek isentropis atau rasio panas jenis tekanan konstan terhadap panas jenis volume konstan :

1. Proses tekanan konstan (isobarik)
Pada proses tekanan konstan, tekanan awal proses sama dengan tekanan akhir proses atau p1= p2 . Bila p = C maka dp = 0. Pada diagram p-V dapat digambar sebagai berikut.
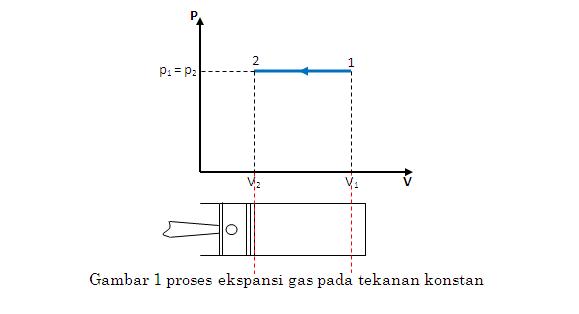
Kerja akibat ekspansi atau kompresi gas pada tekanan konstan dapat dihitung sebagai berikut :

Perubahan energi dalam pada proses isobarik dapat dihitung :

Perubahan kalor pada proses isobarik dapat dihitung :

Dari persamaan gas ideal didapat :

dan

Sehingga :

Entalpi pada proses isobar :

2. Proses volume konstan (isokhorik)
Pada proses isokhorik, volume awal akan sama dengan volume akhir gas atau V1 = V2. Bila V1 = V2 maka dV = 0.
Pada diagram p-V dapat digambar sebagai breikut :

Pada proses isokhorik atau volume konstan, tidak ada kerja yang diberikan atau dihasilkan sistem, karena volume awal dan akhir proses sama sehingga perubahan volume (dV) adalah 0. Pada proses isokhorik semua kalor yang diberikan diubah menjadi energi dalam sistem.

Perubahan energi dalam pada proses isokhorik :

Kalor pada proses isokhorik :

Dimana dV = 0 sehingga dQ = dU = m.cv.(T2 – T1)
Entalpi pada proses isokhorik :

3. Proses temperatur konstan (isotermal)
Pada proses isotermal, temperatur awal proses akan sama dengan temperatur akhir proses atau T1 = T2 . kondisi ini menyebabkan dT = 0 sehingga perubahan energi dalam sistem (dU) = 0.

Kerja pada proses isotermal dapat dihitung :

Dari hukum gas ideal :

Karena T = konstan maka p.V = konstan (C). sehingga
 maka
maka
m, R dan T konstan maka :

Didapat:

Perubahan energi dalam pada proses isotermal adalah 0 sehingga besar perubahan kalor akan sama dengan kerja pada proses isotermal.

Perubahan entalpi pada proses isotermal :

4. Proses Isentropis (adiabatis reversibel)
Proses adiabatis reversibel adalah proses termodinamika dimana tidak ada kalor yang masuk atau keluar dari sistem (adiabatis) dan proses ini mampu balik (reversibel) artinya tidak ada hambatan atau gesekan. Pada kenyataannya proses ini tidak ada di alam, tetapi penyederhaan yang demikian dapat mempermudah untuk menganalisa sistem. Pada p-V diagram dapat digambarkan sebagai berikut.

Karena tidak ada kalor yang dapat masuk dan keluar dari sistem, maka tidak ada perubahan kalor atau dQ = 0. Sehingga kerja yang diberikan atau dilakukan oleh sistem akan mengubah energi dalam sistem. Proses ini berlangsung pada kondisi p.Vk = konstan. Dimana k adalah rasio panas jenis pada tekanan konstan dengan panas jenis pada volume konstan atau sering disebut juga sebagai index isentropis. Kerja pada proses adiabatis reversibel dapat dihitung sebagai berikut :

Karena proses berlangsung pada kondisi p.Vk = C , maka:

sehingga :

Perubahan energi dalam sistem adiabatis reversibel :

Tidak ada kalor yang masuk atau keluar sistem sehingga :

Entalpi pada proses adiabatis reversibel :
Entalpi proses adiabatis reversibel adalah massa dikali panas jenis tekanan konstan dan dikali dengan delta temperatur. Dari mana asalnya coba turunin sendiri. Petunjuk dQ = 0 untuk proses ini.
5. Proses polytropis
Proses polytropis adalah proses termodinamika dengan index isentropis k = n dimana n > 1 atau p.Vn = C. Proses ini sama dengan proses adiabatis reversibel hanya dibedakan jika pada proses adiabatis, kalor tidak dapat keluar atau masuk ke sistem, tetapi pada proses ini kalor dapat berubah (dapat keluar – masuk sistem). p – V diagram untuk proses politropis sama dengan p-V diagram proses adiabatis.
Kerja pada proses politropis adalah sama dengan kerja pada proses adiabatis reversibel, hanya k diganti dengan n dimana n > 1.

Karena proses berlangsung pada kondisi p.Vn = C , maka
 sehingga :
sehingga :
Perubahan energi dalam sistem politropis :

Perubahan kalor dalam sistem politropis :

Bila n pada proses politropis sama dengan 1 maka proses akan berjalan mengikuti proses isotermal, sedangkan bila besar harga n = k, maka proses akan berjalan berdasarkan proses adiabatis reversibel dan bila n sama dengan 0, maka harga vn akan sama dengan 1 sehingga proses akan mengikuti proses tekanan konstan.
https://djukarna.wordpress.com/2014/05/07/proses-proses-termodinamika/

Tidak ada komentar:
Posting Komentar